

金ナノ粒子シェル構造により1粒子の吸光度を向上
インフルエンザや新型コロナウィルスなど感染症の抗原検査としては、イムノクロマト法(注2)が一般的です。この方法では、プローブとして検出抗体を結合した金ナノ粒子が用いられています。しかしながら金ナノ粒子のサイズが数nm〜数10 nmと小さく、光学断面積が小さいため、検出のためには大量の粒子を必要とするという課題がありました。
東北大学材料科学高等研究所(WPI-AIMR)の藪浩教授(主任研究者、同研究所水素科学GXオープンイノベーションセンター副センター長)、および綜研化学(株)新規事業企画部からなる研究グループは、高分子の相分離と静電相互作用を用いた自己組織化プロセスにより、高い光学密度をもつコンポジット微粒子(Gold Nanoparticle Decorated Polymer (GNDP) 粒子)を作製し、そこにインフルエンザ抗原に対する抗体を結合すること、抗原を高感度に検出できる検出プローブとなることを見出しました(図1)。本成果はインフルエンザなどの感染症の高感度な検出を可能とするだけでなく、抗原量の定量測定や、さまざまな疾病マーカーを高感度に検出する新たなプローブ粒子としての利用が期待されます。
本研究成果は、現地時間の1月30日に米国化学会におけるコロイド・界面科学分野の代表的な専門誌Langmuirのオンライン速報版に掲載され、同誌のSupplementary Coverにも採用されました。
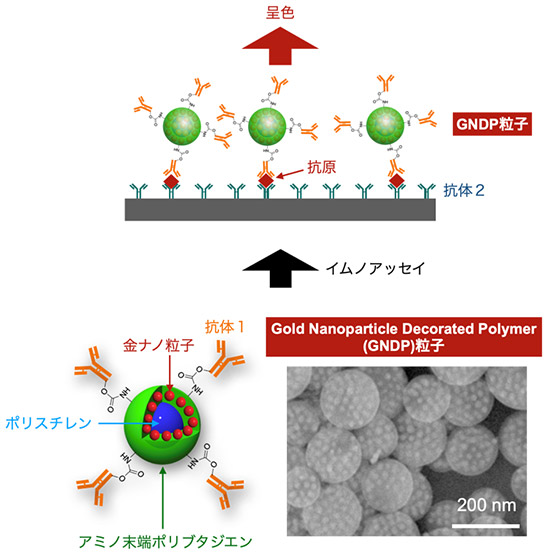
図1. 本研究で開発したGNDP粒子プローブと抗原抗体反応検査(イムノアッセイ)の原理図。
近年新型コロナウィルスやインフルエンザなどの感染症検査に対する需要の高まりから、高感度で定量的な抗原検査技術の開発が求められています。抗原検査には、基材に固定した抗体と、呈色や蛍光発光するプローブを結合した抗体で抗原を挟み込み、抗原を認識するサンドイッチアッセイが通常用いられています。高感度で定量的な検査のためには、抗原を高感度に認識する抗体セットだけでなく、少ない量でも呈色する高感度なプローブが必要です。一般的な抗原検査で使用されるイムノクロマト法では、被表面積が大きく、抗体を表面に結合可能で可視光でプラズモン吸収(注3)により着色する金ナノ粒子が主に使われてきました。
しかし金ナノ粒子は高価な上に粒子サイズが小さいため、抗原抗体反応のプローブとして呈色させるためには、大量の金ナノ粒子が必要であり、感度が稼げない上、十分な感度を得ようとすると高価になるなどの課題がありました。この課題を解決するためには、粒子あたりの光学密度(吸光度)を上げる必要があります。金ナノ粒子のサイズを大きくすれば吸光度は上がりますが、比重の重い金ナノ粒子のサイズを上げると凝集してしまうなどの別の問題が生じます。そこで分散状態を保ったまま、吸光度を上げる手法が求められていました。
これまで研究グループでは、高分子を有機溶媒に溶かした溶液に高分子の貧溶媒を加え、良溶媒を蒸発除去することにより、高分子微粒子を得る「自己組織化析出(Self-ORganized Precipitation, SORP)法を独自に開発し、極性高分子と非極性高分子を混合した溶液からコアシェル型の高分子微粒子が得られること、極性高分子にアミノ基など電離可能な官能基が存在すると、粒子が正に帯電すること、さらにその水分散液に負に帯電した金ナノ粒子を加えると、静電相互作用(注4)により金ナノ粒子がコアシェル型高分子微粒子の表面に吸着し、密に配列して水中に分散可能なコンポジット微粒子(GNDP粒子)が得られることを見出していました(参考文献1)。そこで研究グループは、このGNDP粒子をプローブとして用いれば、大きな吸光度と分散性を兼ね備えた抗原抗体反応用プローブとして応用できるのではないかと考えました。
そこでまずアミノ末端ポリブタジエン(PB-NH2)とポリスチレン(PS)からなるコアシェル型粒子をSORP法により作製しました。得られたコアシェル型粒子はPSがコア、PB-NH2からなるシェルを持ち、PB-NH2のアミノ基により、中性付近の水中で正に帯電します。そこに、5 nm、10 nm、20 nmの粒径を持つ負に帯電した金ナノ粒子を混合することで、各金ナノ粒子が表面に密に配列したGNDP粒子を作製しました。吸光度を比較したところ、20 nmの粒径を持つ金ナノ粒子をコンポジット化したGNDP粒子が大きな吸光度を持ち、かつ分散性を維持していることがわかりました(図2)。
そこで得られたGNDP粒子を用いて市販されているELISA(Enzyeme-Linked Immuno Sorbent Assay)(注5)用インフルエンザキットを利用し、検査プレートとGNDP粒子の表面にインフルエンザ抗原に対する抗体を結合させ、サンドイッチアッセイを行うことにより、GNDP粒子がインフルエンザ抗原検出のプローブとして応用可能か検証を行いました。その結果、GNDP粒子は抗原濃度に対する感度が通常のELISAアッセイに使用される呈色剤や金ナノ粒子と比較しても高く、金ナノ粒子単体では測定が難しい低濃度領域でもアッセイ可能であることが示されました(図3)。
研究グループでは、本粒子を様々な疾病・感染症マーカーとして活用することにより、高感度で安価な疾病・感染症検査キットなどの開発を進めていく予定です。
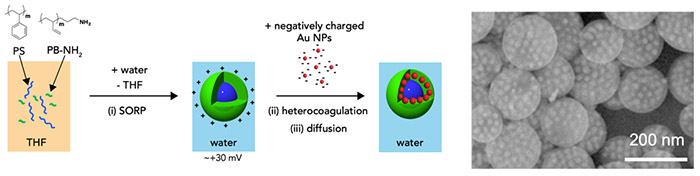
図2. コアシェル型粒子およびGNDP粒子作製の模式図と得られたGNDP粒子の走査型電子顕微鏡(SEM)像(金ナノ粒子のサイズは20 nm)
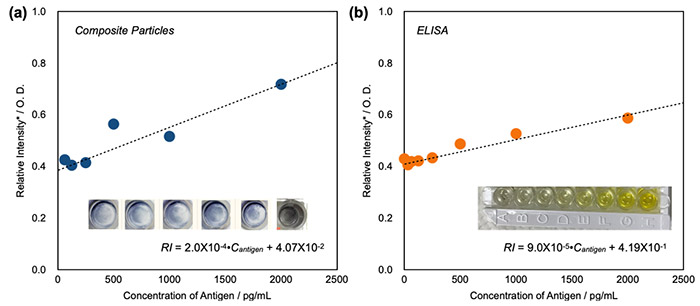
図3. 抗原濃度に対する吸光度の比較。GNDP粒子(a)とELISA(b)。GNDP粒子の方が濃度に対する傾きが大きく、濃度に対する感度が高いことがわかる。(縦軸は規格化した吸光度、横軸は抗原濃度)
本研究の一部は日本学術振興会科学研究費(JP19KK0357)の支援を受けて実施されました。
| タイトル: | Gold Nanoparticle-Decorated Polymer Particles for High-Optical-Density Immunoassay Probes |
|---|---|
| 著者: | Hiroshi Yabu*, Seiji Yokokura, Seiichi Shimizu *責任著者:東北大学材料科学高等研究所 教授 藪 浩 |
| 雑誌名: | Langmuir |
| DOI番号: | 10.1021/acs.langmuir.3c03890 |
東北大学材料科学高等研究所 (WPI-AIMR)
教授 藪 浩(やぶ ひろし)
| Tel: | 022-217-5996 |
|---|---|
| E-mail: | hiroshi.yabu.d5@tohoku.ac.jp |
東北大学材料科学高等研究所(WPI-AIMR) 広報戦略室
| Tel: | 022-217-6146 |
|---|---|
| E-mail: | aimr-outreach@grp.tohoku.ac.jp |